Les faibles rendements des anticorps vous empêchent-ils d’atteindre le marché ? Améliorez les chances de réussite du développement d’anticorps monoclonaux en choisissant une plateforme de développement de lignées cellulaires stables axée sur la capacité de développement. S’appuyant sur 30 ans d’expérience dans la production de protéines et plus de 100 lignées cellulaires stables générées, notre pipeline offre des rendements élevés et stables liés aux garanties les plus solides du marché. La production d’anticorps monoclonaux est simplifiée grâce à nos lignées cellulaires FTO transférables par CMO, qui offrent des rendements élevés (>7g/L) à des prix compétitifs.
Pourquoi choisir les services de phages display d'anticorps
de ProteoGenix ?

Lignées cellulaires FTO
Bénéficiez de notre approche libre de droits pour accélérer le développement clinique.

Facilité de transfert
Transfert rapide des lignées cellulaires et des protocoles à vos partenaires CMO pour la bioproduction cGMP.

Accent mis sur la capacité de développement
Minimiser les risques de production grâce à nos tests précoces approfondis des anticorps candidats.

Diversité de lignée cellulaire
Lignée cellulaire propriétaire CHO, CHO-S, CHO-DG44, HEK293 ou même votre lignée préférée… Obtenez un service adapté à vos besoins !

Productivité record
Assurez-vous que votre lignée cellulaire génère les meilleurs rendements possibles grâce à nos protocoles d’amplification éprouvés.

Rendements garantis
Planifiez à long terme et sécurisez vos investissements en choisissant un service de développement de lignées cellulaires stable et offrant de solides garanties.

Experts en production de protéines
Plus de 500 anticorps monoclonaux développés, plus de 100 lignées cellulaires stables générées, plus de 28 ans d’expérience dans la production de protéines. Choisissez une entreprise de bioproduction de premier plan.

Contrôle total du processus
Gardez le contrôle total de votre projet grâce à notre approche par étapes pour une meilleure flexibilité
Notre procédé de génération de lignées cellulaires stables
pour production d'anticorps monoclonaux

Construction de vecteur d’expression
- Synthèse de gène optimisé pour le système d’expression ciblé.
- Sous-clonage de gènes dans un vecteur d’expression performant.


Etudes de développabilité
- Tests de production en systèmes d’expressions transitoires.
- Evaluation de rendement, de stabilité, de solubilité et de pureté.
- Rapport complet comprenant les garanties, les délais d’exécution estimés et la durée.
GO/NO GO


Transfection de l’hôte et sélection des pools positifs
- Co-transfection avec les vecteurs d’expressions et de sélections.
- Croissance dans des milieux sélectifs pour la sélection de pools positifs.
- Caractérisation des pools stables les plus productifs.
GO/NO GO


Isolement des meilleurs monoclones.
- Isolement des monoclones par dilution limitante ou VIPS™.
- Criblage des clones par ELISA, WB, FACS, IP ou Octet Red96.


Caractérisation des meilleurs monoclones
- Évaluation de la productivité en culture discontinue et/ou fed-batch.
- Préparation RCB et études de stabilité.
GO/NO GO


Optimisation des procédés
- Test de plusieurs milieux de culture, stratégies d’alimentation, conditions de culture, entre autres.


Transfert de lignées cellulaires et de protocoles stables


Client


CMO
Contenu de notre service de synthèse
d'anticorps recombinants
| Etape | Contenu | Délai | Livrables |
|---|---|---|---|
| Synthèse des gènes |
|
3 à 4 semaines |
|
| Étude de faisabilité |
|
3 à 4 semaines |
|
| Génération de pools stables |
|
9 à 10 semaines |
|
| Criblage et sous-clonage de clones de cellules uniques |
|
~4 mois |
|
| Optimisation des procédés |
|
4 à 5 semaines |
|
|
Services optionnels: Avant de commencer:
Après développement de lignées cellulaires stable:
|
|||
Lignées cellulaires stables et systèmes de sélection utilisés pour la production d'anticorps monoclonaux
La plupart des lignées cellulaires de mammifères peuvent être sélectionnées à l’aide de marqueurs métaboliques ou antibiotiques. Les marqueurs les plus utilisés pour la production d’anticorps monoclonaux recombinants sont métaboliques, notamment :
- Marqueurs métaboliques
- Système MTX/DHFR
La dihydrofolate réductase (DHFR) est une enzyme clé dans les voies de synthèse de novo des purines et de certains acides aminés. Le méthotrexate (MTX) est un inhibiteur connu de la DHFR. L’utilisation de cellules déficientes en DHFR (par exemple CHO-DG44) ou la culture en présence de MTX permet la sélection et l’amplification de clones positifs dans un milieu dépourvu d’hypoxanthine et de thymidine (HT). - Système MSX/GS
La glutamine synthétase (GS) catalyse la condensation du glutamate avec l’ammoniac pour produire de la glutamine, contrôlant ainsi le cycle de l’azote et empêchant l’accumulation d’ammoniac toxique à l’intérieur des cellules. Methionine Sulfoximine (MSX) est un inhibiteur connu du GS. L’utilisation de cellules déficientes en GS (par exemple NS0) ou la culture de cellules en présence de MSX permet la sélection et l’amplification de clones positifs.
- Système MTX/DHFR
- Marqueurs antibiotiques
- G418/Geneticine
- Blasticidine
- Hygromycine B
- Puromycine
- Zeocine
- …
Les marqueurs de sélection métabolique sont restés la référence pour la génération de lignées cellulaires stables. Cette préférence peut être expliquée par la versatilité de ces systèmes. En particulier dans les cellules CHO, on ignore que la présence de concentrations croissantes de MTX/MSX entraîne l’amplification des gènes codant pour les anticorps. Par conséquent, cela conduit à une augmentation significative du rendement de production par rapport aux autres systèmes d’expression recombinante.
Cependant, notre objectif reste la flexibilité. C’est pourquoi nous proposons un vaste choix de systèmes de sélection et de lignées cellulaires, ce qui nous permet d’adapter le processus de génération de lignées cellulaires stables à vos exigences et besoins uniques.
Discutez de votre projet avec nos responsables de comptes doctoraux pour recevoir une proposition sur mesure :
Etude de cas: Expression stable d'un anticorps monoclonal de classe IgG1
I. SYNTHESE DE GENE,SOUS-CLONAGE ET PREMIERS TESTS
Les gènes d’anticorps ont été optimisés pour l’expression dans des lignées de cellules CHO, synthétisés et sous-clonés dans notre système propriétaire d’expression transitoire.
Des cellules CHO-K1 (30 ml) ont été transfectées de manière transitoire, des pools transitoires ont été cultivés dans 30 ml, et la purification des anticorps a été effectuée à l’aide d’une résine de protéine G.
confirmant l’intégrité de l’anticorps.
II. DÉVELOPPEMENT DE POOLS STABLES TRANSFECTÉS
- Construction de vecteurs d’expression stables contenant:
- Chaînes d’anticorps lourdes et légères
- Promoteurs du CMV (human cytomegalovirus)
- Signaux de polyadénylation pour une meilleure expression des transgènes
- Glutamine Synthetase (GS) – Le marqueur de sélection
- Determination de la résistance naturelle à la Methionine Sulfoximine (MSX)
- Determination de la résistance naturelle à la Methionine Sulfoximine (MSX)
- Linéarisation vectorielle
- Transfection des cultures en suspension CHO-K1
- Selection en présence de MSX


3 pools stables positifs ont été caractérisés plus avant dans des expériences de fed-batch et les anticorps ont été caractérisés par SEC-HPLC pour confirmer la pureté et détecter une agrégation potentielle.
| ID du pool | Quantité (mg) | Rendement (mg/L) | Pureté |
|---|---|---|---|
| 1 | 37.3 | 1243 | >90% |
| 2 | 39.4 | 1313.3 | >90% |
| 3 | 43.6 | 1453.3 | >90% |
III. PRODUCTION ET PURIFICATION À GRANDE ÉCHELLE
a été réalisée en utilisant la résine de protéine A
VI.ISOLEMENT ET CRIBLAGE DES MONOCLONES STABLES
a été évaluée par ELISA avec des anticorps anti-Fc.
Les données ELISA (ci-dessous) ont révélé 10 monoclones avec des niveaux d’expression élevés.

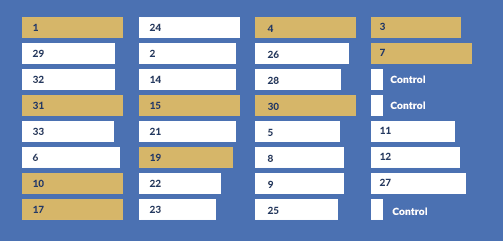
V. EVALUATION DES MONOCLONES STABLES
| ID du clone | 1 | 3 | 4 | 7 | 10 | 15 | 17 | 19 | 30 | 31 |
| Rendement (g/L) | 2.05 | 2.86 | 1.07 | 1.68 | 4.34 | 2.57 | 3.21 | 2.60 | 1.45 | 1.25 |
dans les tests ultérieurs et ont été sélectionnés pour la poursuite du développement.
VI. MISE À L'ÉCHELLE ET OPTIMISATION DE LA PRODUCTION

Pourquoi se concentrer sur la développabilité des anticorps monoclonaux?
95 % des produits biologiques en cours de développement n’atteignent pas le marché ou la clinique en raison de problèmes de développabilité non détectés. Les tests ou le dépistage précoces sont donc devenus cruciaux pour surmonter les faibles taux de réussite et minimiser les risques de développement. La production d’anticorps monoclonaux in vitro via des systèmes transitoires reste le meilleur moyen de produire de petites quantités d’anticorps à mesurer :
- Affinité/avidité
- Specificité/selectivité
- Profil d’agrégation
- Stabilité
- Facilité de purification
- Facilité de mise à l’échelle
Les problèmes détectables à ce stade peuvent être corrigés par une ingénierie supplémentaire des pistes d’anticorps. Ces efforts d’ingénierie, bien que laborieux, peuvent permettre d’économiser des coûts et un temps considérables sur le long terme pour l’homologation de vos anticorps thérapeutiques.
Pour en savoir plus à propos du développement des lignées cellulaires stables, visitez notre page répondant aux questions les plus fréquentes(FAQs): Sur cette page, nous couvrons tous les principes et connaissances séminaux concernant la production d’anticorps monoclonaux dans des cellules stables et fournissons un aperçu détaillé de la plateforme unique de ProteoGenix pour le développement de lignées cellulaires stables.
Vous pourriez également être intéressé par:



