Cart (0 Items)
Your cart is currently empty.
View ProductsAméliorez l’homogénéité, la puissance et la sécurité de vos conjugués anticorps-médicament (ADC) grâce à la plateforme flexible et diversifiée de service de production de conjugués anticorps-médicament (ADC) de ProteoGenix. Forts de plus de 20 ans d’expérience dans le développement d’ADC, nous combinons la forte productivité de la lignée cellulaire XtenCHOᵀᴹ à la grande efficacité de la chimie click pour la conjugaison des anticorps et des méthodes bioanalytiques robustes. Obtenez des ADC de haute qualité avec jusqu’à 90% d’anticorps conjugués avec le ratio médicament/anticorps (DAR) désiré.
Stratégies de conjugaison flexibles
Choisissez entre les méthodes de conjugaison chimique (cystéine et lysine) ou click chemistry selon vos besoins spécifiques.
Diversité des médicaments et développement d’ADC à double charge
Choisissez le meilleur médicament pour une efficacité thérapeutique optimale ou optez pour les systèmes à double charge grâce à notre plateforme click chemistry pour un traitement synergique.
Sans frais de propriété intellectuelle
Gardez la pleine propriété des anticorps développés pour vos applications ADC.
Production d’anticorps accélérée
Accélérez le développement de vos ADC et l’ingénierie des anticorps (affinité, click chemistry, etc.) grâce à notre lignée cellulaire hautement productive – XtenCHOᵀᴹ.
Capacités bioanalytiques étendues
Caractérisez les valeurs de DAR, la distribution de la charge en médicament, le % de médicament et d’anticorps libres avec une haute précision pour garantir une réussite lors du développement clinique.
Solide expérience
Bénéficiez de plus de 20 ans d’expertise dans le développement d’ADC et de 5 ADC thérapeutiques en essais cliniques.
Large gamme de services complémentaires
Optimisez le développement de vos ADC grâce à nos solutions flexibles en découverte d’anticorps (phage display, hybridome), ingénierie (affinité, stabilité) et génération de lignée cellulaire stable.
I. Phase préliminaire (optionnelle)
Sélection du payload et développement ADC
Conjugaison de l’anticorps
Optimisation des ADC et bioanalyse
– Le DAR désiré
– Qualité globale de l’anticorps
L’ADC est livré
Développement de lignée cellulaire stable à haute productivité (optionnel)
Les conjugués anticorps-médicament (ADC) sont une catégorie de médicaments biopharmaceutiques conçus comme des thérapies ciblées précises contre le cancer. Contrairement à la chimiothérapie traditionnelle, les ADC visent à éliminer sélectivement les cellules tumorales, tout en préservant les cellules saines.
Le coût de notre service de production de conjugués anticorps-médicament (ADC) peut varier selon plusieurs facteurs. Nos tarifs commencent à quelques milliers d’euros et augmentent en fonction de la complexité du projet. Le coût final dépend, entre autres, de la source de l’anticorps ou de l’antigène – fournis par vous ou produits par notre équipe d’experts chez ProteoGenix. De plus, la méthode de conjugaison choisie, qu’il s’agisse d’une liaison chimique ou enzymatique, a un impact sur le coût.
Nous nous engageons à offrir des prix justes et transparents pour permettre l’accès à des services ADC de haute qualité. Découvrez le potentiel thérapeutique de vos anticorps grâce à nos solutions de développement ADC économiques. Faites confiance à l’expérience de ProteoGenix (20+ ans), où la qualité rime avec vos contraintes budgétaires.
Chez ProteoGenix, nous savons que le temps est précieux. C’est pourquoi nous nous engageons à réaliser chaque service ADC dans les meilleurs délais et avec priorité. La durée du processus dépend largement de la méthode de conjugaison sélectionnée pour votre projet. En règle générale, le délai varie de quelques semaines à plusieurs mois, selon différents paramètres.
Le délai peut être optimisé si la séquence de l’anticorps est fournie à nos experts, le cas échéant. Dans cette situation, la production ADC peut durer quelques semaines car nous procédons directement au développement avec votre anticorps.
En revanche, si l’anticorps doit être produit ou développé par ProteoGenix, le délai peut s’étendre à plusieurs mois. Notre équipe veille à la production et à la caractérisation efficace de chaque anticorps avant de passer à la phase de conjugaison ADC.
Peu importe le délai, notre priorité est de fournir des solutions ADC fiables et de haute qualité qui répondent à vos objectifs de recherche ou thérapeutiques. Nous restons à vos côtés durant tout le développement et nos chefs de projet PhD vous informent régulièrement de l’avancement du projet.
Nous proposons deux approches distinctes pour chaque service de production de conjugués anticorps-médicament (ADC) : la conjugaison chimique ou enzymatique. Chaque méthode repose sur des principes uniques qui jouent un rôle clé dans le choix de la stratégie la plus adaptée à votre projet.
La conjugaison chimique implique l’attachement covalent du payload aux anticorps via des linkers chimiques spécialisés. La conjugaison enzymatique utilise des réactions enzymatiques pour relier les charges aux anticorps.
Comprendre la différence entre ces méthodes est essentiel pour prendre une décision éclairée. Voici un tableau comparant les points clés entre conjugaison chimique et enzymatique.
| Variables des ADC | Conjugaison chimique | Conjugaison enzymatique |
|---|---|---|
| Site de conjugaison | Site-spécifique | Site-spécifique |
| Étape de conjugaison | 2 étapes | 1 étape |
| Format d’anticorps | IgG entier | IgG entier, scFv, Fab ou VHH |
| Ratio médicament-anticorps | 1, 2 ou 4 | 1, 2, 4 ou 2+2 |
| Type de linker | Clivable et non clivable | Clivable et non clivable |
| Type de payload | Médicament | Médicament, ADN, ARN ou fluorochrome |
| Efficacité de conjugaison | Efficacité moyenne | Haute efficacité |
| Homogénéité d’un lot à l’autre | Homogénéité moyenne | Haute homogénéité |
| Temps de production | ++ | +++ |
| Tarification | +++ | +++ |
Plusieurs facteurs influencent le choix de la stratégie de conjugaison dans le cadre de notre service de production de conjugués anticorps-médicament (ADC). Le budget du client constitue un critère déterminant. Si la conjugaison enzymatique peut être plus rapide, la méthode chimique offre des avantages spécifiques selon les applications.
Le délai du projet du client est également un paramètre clé. Les méthodes enzymatiques, généralement plus rapides, sont privilégiées pour les projets urgents. Par ailleurs, le choix de stratégie dépend aussi du fait que l’anticorps soit fourni par le client ou développé par ProteoGenix.
Le nombre de linkers et de payloads ainsi que le ratio médicament/anticorps (DAR) influencent aussi la sélection. Différentes stratégies donnent des résultats variés en termes de performance et d’efficacité ; nous recommandons donc généralement d’en tester plusieurs en parallèle.
Chez ProteoGenix, notre équipe vous accompagne dans ce choix via un service de conseil gratuit. Nous travaillons en étroite collaboration pour comprendre vos exigences et garantir que la stratégie retenue s’intègre à vos objectifs de projet.
Les experts anticorps de ProteoGenix sont engagés à livrer des ADC d’une qualité et d’une performance exceptionnelles grâce à des protocoles de contrôle qualité rigoureux. Notre service de production de conjugués anticorps-médicament (ADC) prévoit une bioanalyse complète afin de garantir le respect des standards tout au long du développement.
Les ADC comportent les éléments suivants :
Ces molécules combinent la spécificité des immunothérapies à la puissance des agents cytotoxiques. Ces dernières décennies, les ADC ont rencontré un large succès pour le traitement du cancer et notamment des hémopathies. Les progrès continus sur la chimie des linkers et les méthodes de conjugaison ouvrent la voie à la lutte contre de nombreux types de tumeurs.
Étant donné leur structure, les ADC ciblent des récepteurs membranaires abondants, spécifiques des cellules cancéreuses et recyclés efficacement après internalisation. Le mécanisme d’action majeur repose sur plusieurs étapes :
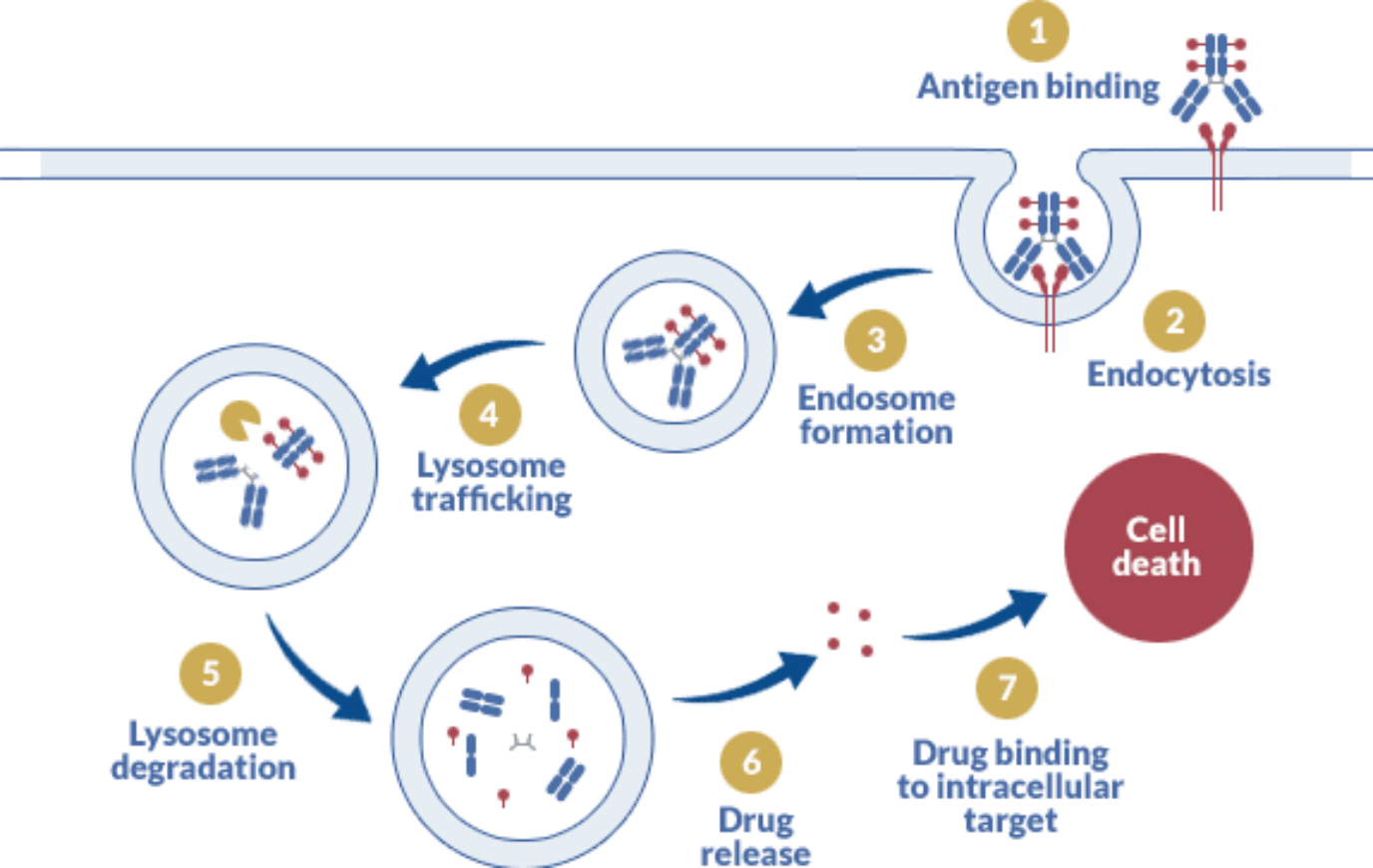
Un mécanisme alternatif repose sur la libération du payload dans le microenvironnement tumoral. Les linkers clivables permettent de déclencher la libération de la charge par signaux chimiques, conditions ou enzymes. Une fois relâchée dans la matrice extracellulaire, la molécule peut diffuser rapidement à travers les tumeurs solides et ainsi contourner la barrière antigénique : cela permet de cibler les cellules cancéreuses qui présentent des mutations importantes sur le récepteur cible (effet bystander).
L’affinement continu de la chimie des linkers et des méthodes de conjugaison ouvre la voie aux ADC comme outils efficaces contre davantage de cancers. Les recherches en cours et les essais cliniques font espérer des traitements plus précis, moins toxiques et potentiellement salvateurs.
Diverses stratégies ont été développées pour attacher les paires linker-payload à l’anticorps. L’efficacité influence directement la charge, la répartition du payload et donc l’homogénéité de l’ADC obtenu.
Les services de production de conjugués anticorps-médicament (ADC) utilisent des linkers chimiques pour lier les cytotoxiques aux anticorps monoclonaux. Les propriétés des linkers déterminent leur stabilité, sécurité et mécanisme d’action. On distingue deux grandes familles : linkers clivables ou non clivables. Voir tableau ci-dessous.
| Chimie du linker | Sous-classe | Groupes | Exemples | ADC approuvés FDA/EMA |
|---|---|---|---|---|
| Clivable | Linkers acido clivables | Hydrazone- disulfures | 4-(4′-acétylphénoxy) acide butanoïque (AcBut linker) | Gemtuzumab ozogamicin; Inotuzumab ozogamicin |
| Clivable | Linkers acido clivables | PEGylés | PEG8- et triazole- PABC-peptide-mc (CL2A linker) | Sacituzumab govitecan |
| Clivable | Linkers enzyme- clivables | Linkers peptidiques | Valine-citrulline (Val-Cit linker), Valine-alanine (Val-Ala linker) | Brentuximab vedotin; Polatuzumab vedotin; Loncastuximab tesirine |
| Linkers non clivables | _ | Linkers thioéther | Succinimidyl-4-(N- maleimidométhyl) cyclohexane-1-carboxylate (SMCC linker) Maleimidocaproyle (MC linker) | Belantamab mafodotin; Ado-trastuzumab emtansine |
Le choix du linker idéal pour un ADC dépend notamment de l’abondance de l’antigène ciblé, de la toxicité du payload et de la nature de la tumeur (solide ou hématologique). On privilégie par exemple des linkers clivables face à des cibles en faible abondance ou pour des tumeurs solides puisqu’ils permettent de relâcher leur charge directement dans le microenvironnement tumoral.
Notre service de production de conjugués anticorps-médicament (ADC) utilise des enzymes pour relier les charges cytotoxiques aux anticorps monoclonaux.
Les meilleures enzymes permettent un couplage ciblé entre l’anticorps et la charge, garantissant une administration précise vers les cellules tumorales tout en épargnant les tissus sains. Cette approche améliore l’efficacité thérapeutique et réduit les effets secondaires. Exemples d’enzymes utilisées :
|
|
|---|---|
|
|
|
|
|
|
|
|
|
|
Les payloads adaptés sont très puissants (activité nanomolaire/picomolaire), solubles, peu immunogènes et porteurs de sites réactifs pour la conjugaison. Ils appartiennent principalement aux familles suivantes : inhibiteurs de tubuline (maytansinoïdes, auristatines) et agents modifiant l’ADN (notamment les calichéamicines). D’autres familles émergent comme les camptothécines et les PBD. Voir tableau :
| Classe de payload | Mécanisme d’action | Exemples | ADC approuvés FDA/EMA |
|---|---|---|---|
| Auristatines | Inhibition polymérisation de tubuline | Monométhyl auristatine E (MMAE) et F (MMAF) | Brentuximab vedotin; Polatuzumab vedotin; Enfortumab vedotin; Belantamab mafodotin; Tisotumab vedotin |
| Calichéamicines | Clivage de l’ADN | Calichéamicine et dérivés | Gemtuzumab ozogamicin; Inotuzumab ozogamicin |
| Camptothécines | Inhibiteur de topoisomérase | Dérivé d’exatéchan (Dxd) et d’irinotécan (SN-38) | Trastuzumab deruxtecan; Sacituzumab govitecan |
| Maytansines | Dépolymérisation de la tubuline | Maytansinoïdes (DM1 et DM4) | Trastuzumab emtansine |
| PBD dimères | Cross-linker sillon mineur ADN | Dérivés PBD | Loncastuximab tesirine |
| Toxines protéiques | Divers | Exotoxine de Pseudomonas (PE), diphtérie (DT) | Moxétumomab pasudotox |
| Duocarmycines | Agent alkylant ADN – sillon mineur | CC-1065 et duocarmycin SA | Aucun à ce jour |
| Amatoxines | Inhibiteur de l’ARN polymérase II | α-Amanitine | Aucun à ce jour |
| Antibiotiques | Divers | 4-diméthylamino piperidino-hydroxybenzoxazino rifamycine (dmDNA31) | Aucun à ce jour |
| Enzymes | Divers | β-glucuronidase, uréase, ... | Aucun à ce jour |
La bioanalyse des ADC pose des défis importants en raison de l’hétérogénéité de ces produits – surtout lorsque des méthodes de conjugaison chimique classiques sont utilisées (cystéine et lysine). L’hétérogénéité influe sur leur stabilité et leur efficacité, d’où la nécessité d’analyses poussées au cours du développement.
Les principales propriétés et méthodes bioanalytiques utilisées sont :
Parmi ces propriétés, le DAR et la distribution du payload restent les plus critiques. Les méthodes UV/Vis, HIC, RP-HPLC ou LC-MS sont les plus utilisées en développement précoce.
L’hétérogénéité et la complexité des ADC compliquent leur validation clinique. Toutefois, l’optimisation de propriétés clés augmente nettement leurs chances d’obtention d’AMM :
Depuis l’autorisation du Mylotarg (gemtuzumab ozogamicin) en 2020, de nombreux ADC sont arrivés en clinique. Les grandes cibles cancer actuelles et futures incluent :
L’amélioration de la chimie des linkers et des stratégies de conjugaison favorise la création d’ADC de structures ou mécanismes variés. Les grandes tendances pour la prochaine génération d’ADC comprennent :
Une question ou besoin d’un devis ? Envoyez-nous un message et nous reviendrons vers vous sous 48 h.