Cart (0 Items)
Your cart is currently empty.
View ProductsYou're visiting from outside the EU. Switch to the US version to see local pricing and tax details in USD.
Switch to US ($)
Un taux de réussite de 90% et plus de 1500 protéines exprimées démontrent la qualité de notre service de production de protéines en cellules mammifères ! Quelle est notre stratégie gagnante pour une expression protéique à haut rendement ? Systèmes propriétaires performants, une équipe d’experts en protéines et des plateformes dédiées à la production.
Un exemple idéal des données que vous pouvez attendre de ce type de rapport
Ce rapport complet inclut :
Essayez XtenCHOTM, le système d’expression de protéines le plus performant.
En tant qu’expert en production protéique, nous proposons des systèmes d’expression CHO et HEK avec différents protocoles et outils.
Nos cultures cellulaires atteignent 20L par lot. Obtenez des quantités multi-grammes en 4 semaines !
Nous proposons une solution adaptée à vos besoins.
Avec plus de 1500 protéines produites et un taux de réussite supérieur à 90%, notre expertise est unique.
Nous gérons votre projet de la synthèse de gènes jusqu’à l’expression protéique.
XtenCHOTM est la nouvelle référence en matière de production de protéines. Après de nombreuses années de recherches intensives, ProteoGenix a mis au point un système surpassant ExpiCHO, la référence du secteur. Consultez des résultats sur notre page de production d’anticorps recombinants.
Ceci n’est qu’une démonstration des performances remarquables de notre système propriétaire d’expression. Ne manquez pas l’opportunité de booster votre production de protéines avec XtenCHOTM !
| Étape | Contenu | Délais | Rendus |
|---|---|---|---|
| Synthèse de gène |
|
4 à 5 semaines |
|
| Étude pilote |
|
4 à 5 semaines |
|
| Expression et purification transitoire de protéine |
|
3 à 4 semaines |
|
| Génération de pool cellulaire stable |
|
Sélection du pool |
|
| Génération de lignée cellulaire stable |
|
20 semaines |
|
Options
ProteoGenix s’engage à proposer à ses clients les plateformes les plus avancées pour la production de protéines. Grâce à XtenCHOTM et notre lignée cellulaire déficiente en GS, nos experts développent leurs propres outils pour repousser les limites de votre expression et répondre à chaque défi.
Besoin d’une production rapide, multi-gramme ? Vous cherchez une lignée cellulaire pour une production recombinante sur le long terme ? Vous êtes au bon endroit !
| Expression protéique transitoire |
|---|
|
| Génération de pool cellulaire stable |
|---|
|
| Génération de lignée cellulaire stable |
|---|
|
Les IgG de lapin offrent une grande affinité et spécificité. Néanmoins, leur faible rendement limite leur utilité (rendement moyen ~20 mg/L). ProteoGenix obtient des rendements supérieurs à 200 mg/L.
Une culture cellulaire CHO a été co-transfectée de manière transitoire avec des vecteurs codant pour la chaîne lourde (HC) et légère (LC) de l’IgG de lapin. Les cellules ont été récoltées 6 jours après la transfection. L’anticorps cible a été purifié par affinité.
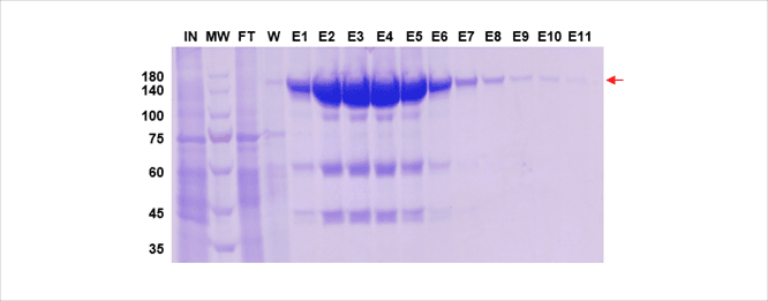
Figure 1 : Profil de purification de l’anticorps cible. Coloration bleu Coomassie.
Analyse non réductrice.
MW : marqueur de poids moléculaire. IN : entrée. FT : flux traversant. W : lavages. E : fractions éluées
Après purification, les fractions d’intérêt sont regroupées puis concentrées et dialysées. Un contrôle qualité final est réalisé par SDS-PAGE en conditions réductrice et non réductrice.
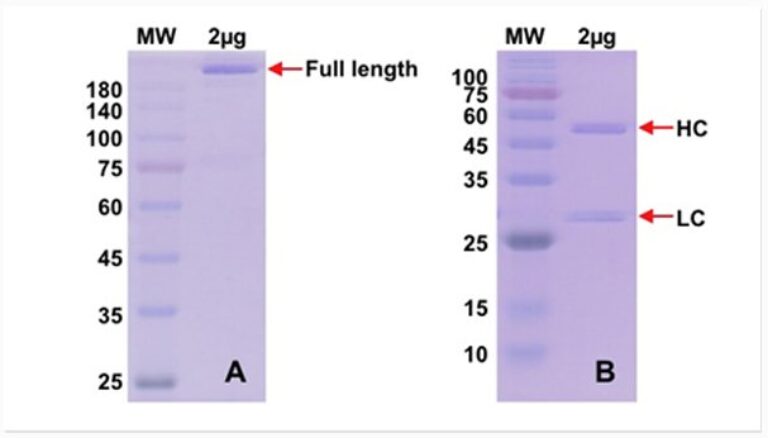
Figure 2 : Contrôle qualité final de la mAb recombinante purifiée. Coloration bleu Coomassie.
2µg d’échantillon par puits
| Rendement / mg/L | Pureté / % | |
|---|---|---|
| IgG de lapin | 265 | 90 |
L’obtention de protéines en quantités multi-grammes est souvent requise en recherche académique (analyse fonctionnelle, cristallographie…) ou pour des projets industriels/biopharmaceutiques. Atteindre des rendements élevés via les cellules mammifères était difficile. Aujourd’hui, plusieurs grammes par litre sont désormais possibles, ce qui rend la technologie économiquement viable. Ces avancées dans le service de production de protéines en cellules mammifères ont été encouragées par la multiplication des biothérapeutiques produits dans ces systèmes.
De plus en plus d’investissements sont consacrés au développement de biopharmaceutiques comme les anticorps thérapeutiques ou protéines. Dans ce contexte, la production de protéines par cellules mammifères suscite un grand intérêt.
La principale différence entre lignées bactériennes et cellules mammifères réside dans la présence de la machinerie post-traductionnelle. Seule la production de protéines en cellules mammifères permet d’obtenir une glycosylation adaptée. Ceci est crucial pour la production d’anticorps thérapeutiques : la glycosylation appropriée favorise efficacité, stabilité et sécurité accrues. Les fragments d’anticorps, en revanche, peuvent être produits via systèmes bactériens.
L’expression en cellules mammifères permet également un repliement correct, indispensable au maintien de l’activité biologique.
En résumé, la production de protéines recombinantes en cellules mammifères augmente leur compatibilité pour un usage humain. C’est pourquoi elles restent les systèmes de référence pour la production de protéines ou d’anticorps thérapeutiques.
