Cart (0 Items)
Your cart is currently empty.
View ProductsYou're visiting from outside the EU. Switch to the US version to see local pricing and tax details in USD.
Switch to US ($)

Le développement d’anticorps bispécifiques est complexe : format, stabilité et spécificité ont un impact direct sur le succès. Nous vous apportons stratégie et conseils d’experts pour sélectionner des candidats pertinents, en évitant les conceptions à risque d’échec en aval. Nous vous recommandons également des formats et mutations respectueux de la propriété intellectuelle pour réduire les risques liés aux brevets et limiter les frais de licences.
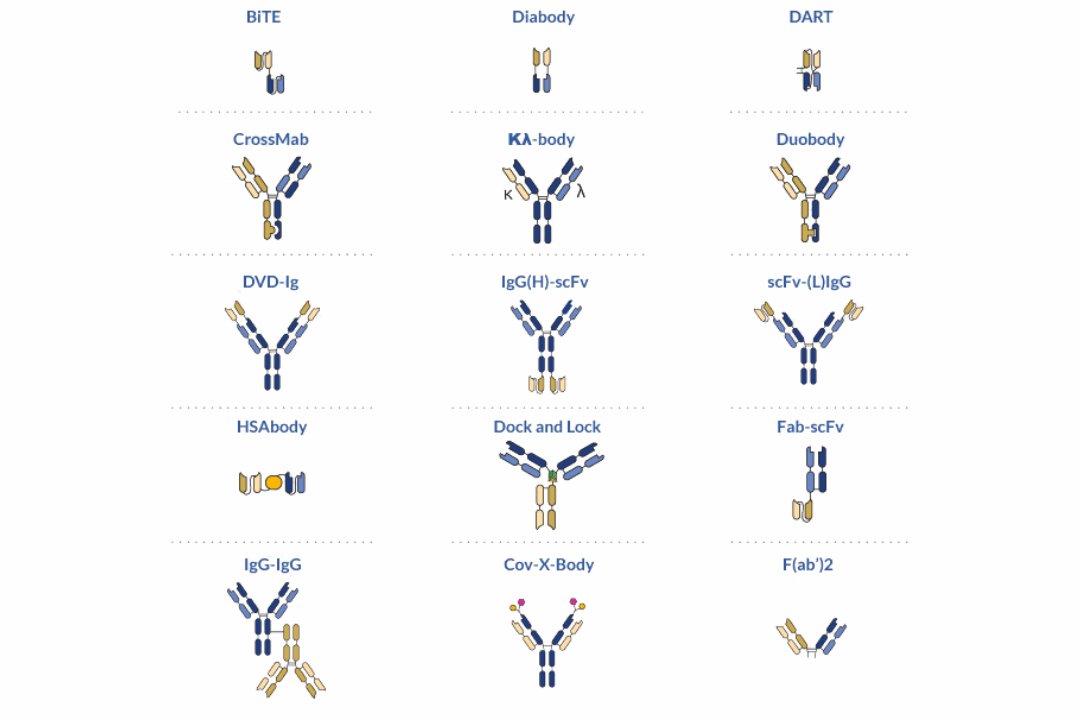
Avec la plus large boîte à outils de formats bispécifiques du marché et notre plateforme de production d’anticorps haut débit, nous vous aidons à concevoir n’importe quel design sans limites techniques et selon votre budget.
