Cart (0 Items)
Your cart is currently empty.
View ProductsYou're visiting from outside the EU. Switch to the US version to see local pricing and tax details in USD.
Switch to US ($)
Suchen Sie eine verlässliche Methode zur Entdeckung hochwertiger Antikörper gegen Krebs? Die weltweit erste humane Immun-Phagen-Display-Bibliothek von Krebspatienten bietet eine innovative Lösung. Diese einzigartigen Bibliotheken sind eine reiche Quelle hochaffiner, tumorspezifischer Antikörper und ideal für die Entwicklung der nächsten Generation der Krebsimmuntherapie geeignet. Mit 3 therapeutischen Antikörpern am Markt und über 30 in der präklinischen und klinischen Entwicklung können Sie sich auf ProteoGenix verlassen. Möchten Sie Ihren Anti-Krebs-Antikörper individuell anpassen? Wir sind auf die Verbesserung der Entwickelbarkeit und fortschrittliche Anpassungen jeder Antikörpersequenz spezialisiert – exakt auf Ihre Anforderungen zugeschnitten. ProteoGenix ist Ihr umfassender Partner für alle maßgeschneiderten Antikörper gegen Krebs. Buchen Sie jetzt einen Termin mit unseren Antikörper-Experten!
Unsere einzigartige humane Krebs-Immunbibliothek beschleunigt die Entdeckung neuer Zieltherapien und den Markteintritt.
Sie besitzen die generierten maßgeschneiderten monoklonalen Anti-Krebs-Antikörper.
Wir liefern mindestens 3 einzigartige Antikörper, die Ihr krebsspezifisches Antigen erkennen.
Sparen Sie Zeit und Geld durch die Nutzung unserer bestehenden humanen Immun-Phagen-Display-Krebsbibliotheken.
Expertise in der Entwicklung vollhumaner klinischer Antikörper ohne Humanisierung – einzigartig im Vergleich zu den meisten Anbietern.
Unsere Zusatzleistungen reduzieren Ihren Aufwand: Von der Herstellung von Antigenen bis zur Qualitätskontrolle und Prüfung der Entwickelbarkeit – alles aus einer Hand!
Sichern Sie Ihre Investition mit milestone-basierten Services für komplexe und risikoreiche Projekte.
Unsere vorkonfigurierten Krebsbibliotheken verbinden individuelle Immunbibliotheken mit verkürzter Lieferzeit um mehrere Monate!
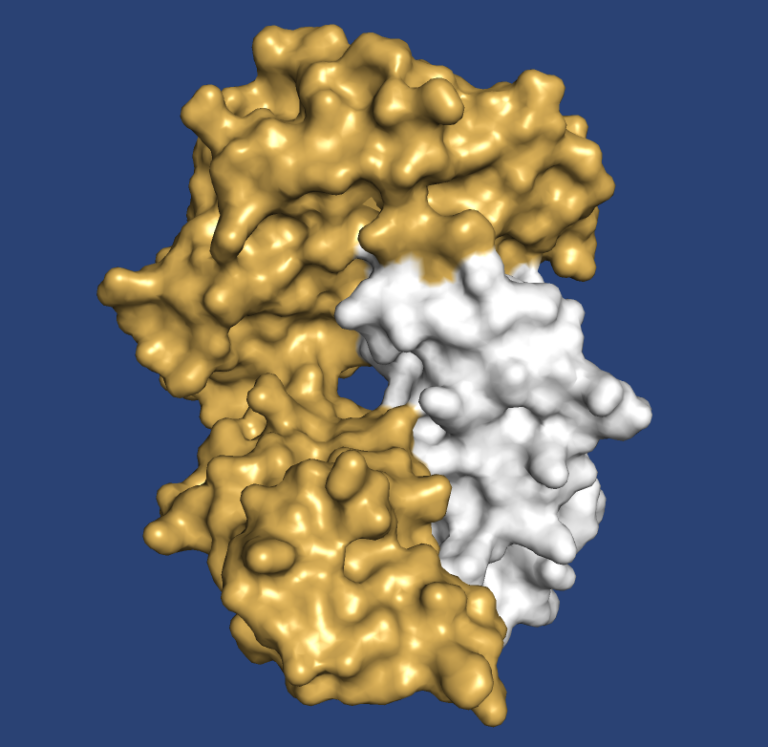
Neue Perspektiven für die Krebs-Immuntherapie
Erfahren Sie, wie wir Antikörper gegen ein Ziel entwickelten,
das dem Immunsystem kaum sichtbar war
Antigen-Beschaffung, -Design und -Herstellung
Ihr krebsspezifisches Antigen kann wie folgt bereitgestellt werden:
Screening der Immun-Bibliothek und Biopanning
ELISA-Screening von Einzel-Phagen-Bindern
Bis mindestens 3–10 verschiedene Binder identifiziert wurden.
DNA-Extraktion & Antikörper-Sequenzierung
Das Antikörper-Phagen-Display ist eine der leistungsstärksten Methoden zur Herstellung monoklonaler Antikörper am Markt. Früher musste man für hochaffine, krebsspezifische Antikörper eine zeitintensive und kostenaufwendige Bibliothek aus immunisierten Versuchstieren herstellen.
Mit ProteoGenix gehören diese Nachteile der Vergangenheit an: Wir bieten als erstes Unternehmen eine gebrauchsfertige, humane Immun-Antikörper-Phagen-Display-Bibliothek von Krebspatienten an. Jede Immunbibliothek (scFv- und Fab-Bibliothek) liefert hochaffine, tumorspezifische Antikörper, wie sie sonst nur in individuellen Bibliotheken aus immunisierten (nicht-humanen) Tieren vorkommen. Unsere vorkonfigurierte humane Immun-Krebs-Antikörper-Bibliothek kombiniert die schnelle Lieferung und niedrigeren Kosten von naiven Bibliotheken mit dem Reichtum an hochaffinen Antikörpern immunisierter Wirte – das Beste aus beiden Welten.
| Bibliotheksname | Spezies | Klonszahl |
|---|---|---|
| LiAb-SFCANCERTM Bibliothek | Humane Spender (48 Patienten mit 7 verschiedenen Krebsarten):
|
3,81x1010 (scFv) 3,72x1010 (Fab) |
Die vorgefertigten Immun-Krebsbibliotheken von ProteoGenix sind eine Fülle neuartiger Krebsimmuntherapien. Mit einer gewaltigen Vielfalt an einzigartigen Antikörpern (>3×1010 verschiedene Klone) und einer hervorragenden In-Frame-Frequenz (>93%) bietet jede Bibliothek eine breite Auswahl neuer Kandidaten.
Hochleistungsantikörper, die Krebsantigene mit minimaler Kreuzreaktion binden, sind schwer zu entwickeln. Unsere humanen Immun-Krebsbibliotheken sind jedoch besonders nützlich zur Entwicklung monoklonaler Antikörper gegen hochkonservierte, in menschlichem Krebs vorkommende Antigene. Dazu gehören:
Mit den naiven humanen Krebsbibliotheken von ProteoGenix erhalten Sie IP-freie DNA-Sequenzen von drei hochaffinen Bindern gegen Ihr Zielantigen.
Jedes Projekt dauert ca. 8 Wochen — von Antigendesign und -purifikation bis zur Lieferung Ihrer Antikörper-DNA-Sequenzen. Das ist eine der schnellsten Lieferfristen auf dem Markt.
ProteoGenix bietet weitere Zusatzservices für maximale Bequemlichkeit:
Durch die Kombination unserer Entwicklung von Anti-Krebs-Antikörpern mit Services zur Expression, Entwickelbarkeit und Individualisierung können Sie auch anspruchsvollste Projekte an unsere Experten auslagern – das spart Zeit, Geld und Ressourcen und beschleunigt Ihre Markteinführung.
Nutzen Sie das volle Potenzial des Phagen-Displays mit unserer proprietären Bibliothek. Anders als bei anderen Methoden, wo variable Regionen von Kappa- und Lambda-Leichtketten zusammengeführt werden, trennen wir deren Verarbeitung. So entstehen mehr verschiedene Antikörperklone und der Bias wird minimiert.
Durch diesen Ansatz werden die Chancen erhöht, hochaffine Antikörper ohne Kreuzreaktionen gegen schwer zugängliche Antigene wie Krebs-Neoantigene zu entdecken. Dies erhöht die Qualität – und mit ihr die Chance, mit Ihrem Antikörper klinische Entwicklungsphasen zu erreichen.
Das Immunsystem von Krebspatienten erkennt und eliminiert Krebszellen in den frühen Stadien oftmals nicht. Die fehlende Unterscheidung zwischen „selbst“ und „nicht-selbst“ ermöglicht Krebszellen das Entkommen vor der Immunüberwachung.
Später erkennt die adaptive Immunantwort die entstehenden Neoantigene der Tumorzelle – aber meist zu spät, um das Wachstum des Tumors zu verhindern.
Obwohl frühe Krebszellen dem Immunsystem zunächst entgehen, bleibt ihr Vorteil nicht von Dauer. Das Immunsystem entwickelt schließlich eine adaptive Antwort gegen den Tumor. Eine Immun-Phagen-Display-Bibliothek von Krebspatienten ist daher eine unerschlossene Quelle neuartiger Anti-Krebs-Antikörper – so zugänglich wie nie zuvor.
Eine aus einem Krebspatienten stammende Antikörperbibliothek umfasst Antikörper, die gegen Tumorantigene gereift und selektiert wurden. Damit sind sie im Vergleich zu naiven Bibliotheken aus gesunden Spendern affiner und therapeutisch interessanter.
Durch die Verwendung einer humanbasierten Bibliothek wird das Risiko für Immunogenität und Nebenwirkungen minimiert. Diese Neuerung beschleunigt die Entwicklung neuartiger, wirksamer und patientenspezifischer Antikörper für die onkologische Immuntherapie.
Antikörper aus unseren humanen Krebs-Phagen-Display-Bibliotheken zeichnen sich durch ihre Fähigkeit aus, tumorspezifische Antigene gezielt zu adressieren. Damit bieten sie präzise und wirksame therapeutische Ansätze, weil sie durch die komplexe Tumorumgebung eine natürliche Affinitätsreifung erfahren haben.
Jede unserer Bibliotheken ist somit eine Quelle hochspezifischer Antikörper und erschließt neue Wege für die Entwicklung innovativer Onkologie-Therapien.
Nachfolgend ein Vergleichstabelle der Antikörpereigenschaften von naiven Krebs-Donoren, gesunden Spendern und immunisierten Wirten:
| Naive Antikörperbibliothek (humaner Spender) | Immunbibliothek (humaner Spender) | Immunbibliothek (nicht-humanes Tier) | |
|---|---|---|---|
| Quelle | Gesunde menschliche Spender | Krebspatienten | Immunisierte Tiere (nicht-human) |
| Antikörperdiversität | Breit | Krebsantigenspezifisch verschoben | Immunisiertes Antigenspezifisch verschoben |
| Zielspezifität | Begrenzte antigenspezifische Antikörper | Erhöhte Anzahl an krebsspezifischen Antikörpern | Erhöhte Anzahl an antigenspezifischen Antikörpern |
| Affinitätsreifung | Minimale Affinitätsreifung | Affinitätsreifung an Tumorantigene | Affinitätsreifung am immunisierten Antigen |
| Therapeutische Anwendungen | Potenzial für breite Anwendungen | Potenzial für krebsspezifische therapeutische Antikörper | Fokussierung auf immunisierendes Antigen |
| Immunogenitätsrisiko | Vollhuman – minimales Immunogenitätsrisiko | Vollhuman – minimales Immunogenitätsrisiko | Risiko einer Immunantwort |
| Klinische Umsetzung | Erfordert evtl. weitere Optimierung | Beschleunigte Entwicklung krebsspezifischer Therapeutika | Kann weitere Charakterisierung und Optimierung erfordern |
Antikörper-Phagen-Display ist eine Labormethode zur Untersuchung der Interaktion zwischen Antikörpern und anderen Molekülen wie Antigenen. Hierfür wird die DNA von Bakteriophagen (Viren, die Bakterien infizieren) genetisch modifiziert, indem Antikörper-Gene mit einem Phagenhüllprotein fusioniert werden.
Dadurch präsentiert der Phage den Antikörper auf seiner Oberfläche – das Gen bleibt im Innern erhalten. Es entsteht eine Verbindung zwischen Genotyp und Phänotyp. Die so ausgestatteten Phagen können gegen spezifische Antigene gescreent werden, um bindende Antikörper zu identifizieren. Das Screening und die Amplifikation auch riesiger Bibliotheken gelingt so im Labor durch „künstliche Auswahl“.
Eine Phagen-Display-Bibliothek für Antikörper entsteht durch Klonierung der variablen Antikörper-Gene in einen modifizierten Phagenvektor. Ausgangspunkt ist die Gewinnung von mRNA aus B-Zellen eines (Tier- oder Human-)Spenders. Nach der Rücktranskription in cDNA werden spezifische Primer verwendet, um variable Bereiche der schweren und leichten Kette durch PCR zu amplifizieren.
Diese variablen Regionen werden in einen Phagen-Display-Vektor kloniert, der für die Expression dieser Sequenzen als Fusionsprotein mit einem Hüllprotein sorgt. So kann der Antikörper außen am Phagen präsentiert werden, während das Gen im Partikel verbleibt.
Die Bibliothek lässt sich anschließend auf ein Zielantigen screenen, sodass Phagen mit bindenden Antikörpern identifiziert werden können. Durch die Sequenzierung der Antikörper-DNA und ihre Produktion können so gewünschte Antikörper für weitere Analysen oder therapeutische Zwecke hergestellt werden.
Eine naive Antikörper-Phagen-Display-Bibliothek wird aus den Genen eines Organismus aufgebaut, der noch nie Kontakt mit dem Zielantigen hatte. Immunbibliotheken hingegen stammen von Organismen, die gegen das Zielantigen immunisiert wurden.
Naive Bibliotheken enthalten eine breite Auswahl an Antikörpern, die keine antigenspezifische Auswahl erfahren haben – ideal, um neue Bindermotive zu identifizieren. Immunbibliotheken beinhalten hingegen Antikörper, die bereits zielgerichtet auf das entsprechende Antigen selektiert wurden, was eine schnelle Identifikation hochaffiner Binder erlaubt.
Der Unterschied liegt also in der Herkunft der Gene: Während naïve Bibliotheken Diversität bieten, enthalten Immunbibliotheken gezielt ausgewählte, bindende Antikörper.
Ein Single-Chain-Variable-Fragment (scFv) ist eine Fusionsstruktur, die die variablen Regionen der schweren (VH) und leichten Kette (VL) eines Antikörpers über einen kurzen Peptid-Linker (ca. 10–25 Aminosäuren) miteinander verbindet. Dieser Linker ist meist reich an Glycin (Flexibilität), enthält oft Serin oder Threonin (Löslichkeit) und verbindet entweder das N-Terminus von VH mit dem C-Terminus von VL oder umgekehrt.
Das scFv-Format bietet zahlreiche Vorteile gegenüber elterlichen monoklonalen Antikörpern (mAb), darunter:
Diese Eigenschaften machen scFv besonders attraktiv für die therapeutische und diagnostische Anwendung und bieten zahlreiche Möglichkeiten zur weiteren Optimierung antikörperbasierter Therapien.
Das Fragment Antigen Binding (Fab) ist ein Segment des Antikörpers, das an Antigene bindet. Es besteht aus je einer variablen und einer konstanten Domäne der schweren und leichten Kette. Die Variable enthält das Paratop – den Teil des Antikörpers, der binden kann und mehrere Komplementaritätsdeterminanten am N-Terminus des Fab-Monomers enthält. So kann jeder „Antikörperarm“ ein Epitop am Antigen erkennen.
Das Fab-Format bietet ebenfalls einige Vorteile im Vergleich zu vollständigen monoklonalen Antikörpern (mAb):
Die speziellen Merkmale des Fab-Formats machen es zu einer attraktiven Option für unterschiedliche medizinische Anwendungsfelder – mit mehr Leistung, Flexibilität und Wirtschaftlichkeit gegenüber kompletten mAb.
