Gracias a nuestra exclusiva plataforma para la determinación de la KD, ProteoGenix es EL referente en materia de medición de la afinidad de anticuerpos. ¡La medición de las interacciones con células, bacterias o proteínas en su conformación nativa o la realización de una determinación de la KD «high throughput» ya es posible gracias a nuestras 3 tecnologías! Envíenos sus requisitos y nuestros gestores de cuentas doctorados definirán la mejor solución para cumplir sus expectativas en materia de exactitud/precio/plazo de entrega.
¿Por qué elegir ProteoGenix para el desarrollo
y la determinación de la KD de anticuerpos?

Precio competitivo
¡Garantizamos el precio más bajo del mercado!

3 tecnologías complementarias diferentes
Medición de la afinidad de anticuerpos mediante SPR, SPRi u Octet.

Un servicio exclusivo de medición de la afinidad anticuerpo-célula
También compatible con la determinación de la KD «high throughput».

Equipos de vanguardia
Somos uno de los pocos proveedores de servicios que ofrecemos la determinación de la KD de anticuerpos mediante SPRi

Medición sin marcadores
Sin plazos de entrega adicionales, sin costes extra, sin artefactos ni sesgo (sitio de unión ocluido, interacción hidrofóbica falsa)

Gestores de cuentas doctorados
¿Necesita consejo para seleccionar la tecnología correcta? Nuestros gestores de cuentas doctorados le ayudarán a elegir la tecnología más adecuada en su caso.

Entrega rápida
Obtenga los valores de la KD de su anticuerpo en 2/3 semanas.
¡Un servicio de medición de la afinidad de anticuerpos adaptado a sus necesidades!
Habiendo ya desarrollado y caracterizado más de 300 anticuerpos monoclonales para diversos clientes, ProteoGenix goza de una gran experiencia en el análisis de interacciones biomoleculares. Tanto si su proyecto implica una determinación de la KD «high throughput», como si requiere un análisis de muestras brutas (células, bacterias,…), tenemos a nuestro alcance todas la tecnologías necesarias para ofrecerle la solución más adecuada a sus necesidades.
|
|
 SPR/Biacore X100–T200–8K de GE
|
 SPRi/XelPleX de Horiba
|
 Octet / ForteBio Octet Red
|
|---|---|---|---|
| Aplicación de referencia | «Tecnología de referencia» Determinación de la KD «high throughput» Interacción anticuerpo-antígeno Análisis de interacciones biomoleculares |
Determinación de la KD «high throughput» Análisis de la interacción anticuerpo-célula Análisis de interacciones biomoleculares |
Determinación de la KD «high throughput» Análisis de interacciones biomoleculares |
| Tecnología | Resonancia de plasmón superficial (SPR) | Adquisición de imágenes de resonancia de plasmón superficial (SPRi) | Interferometría |
| Principio de medición | Cambio del índice de refracción | Cambio del índice de refracción | Desplazamiento de la longitud de onda |
| Sin marcadores | Sí | ||
| Análisis de muestras brutas (células, bacterias,…) | No | Sí | Sí |
| Posibilidad de revestir proteínas (que no sean anticuerpos) manteniendo su conformación nativa | No | Sí | No |
| Adquisición de imágenes | No | Sí | No |
| Multiplexación | ++ | ++++ | ++ |
| Límite de detección | +++ | +++ | + |
| Complejidad tecnológica | + | +++ | ++ |
| Coste/anticuerpo | + | +++ | ++ |
| Plazo de producción | 2/3 semanas | ||
¿Tiene dudas acerca de cuál es la técnica de determinación de la KD más adecuada para su estudio?
Envíe sus requisitos a nuestro gestor de cuentas doctorado.
Estudio de caso 1: determinación de la KD entre un anticuerpo anti-proteína X y la proteína X expresada en la superficie de células 293T mediante tecnología SPRi (XelPleX de Horiba)
OBJETIVO DEL ESTUDIO
Un cliente nos solicitó la medición de la afinidad de unión del anticuerpo anti-proteína X frente a una proteína X transmembrana expresada en la superficie de células 293T. La expresión y presentación de la proteína directamente en la célula nos permitió presentar el epítopo extracelular manteniendo su conformación nativa.
Las mediciones se realizaron utilizando la tecnología de adquisición de imágenes de plasmón superficial (XelPleX de Horiba).
FUNCIONALIZACIÓN DEL BIOCHIP
El biochip se modificó utilizando una estrategia clásica de acoplamiento de amina. En resumen, se activó una superficie con un extremo –COOH utilizando EDC/NHS, lo que condujo a un éster sulfo-NHS reactivo. Este producto intermedio se sabe que reacciona con las aminas primarias para formar un enlace amida estable.
Posteriormente, se ensayaron 2 métodos de deposición del anticuerpo anti-X con el fin de determinar la estrategia de deposición óptima (los detalles se proporcionan en el archivo PDF).
ESTUDIO DE LA ESPECIFICIDAD DE INTERACCIÓN ANTICUERPO-CÉLULA
Se ensayó la unión específica de las células de proteína X comparando las curvas cinéticas obtenidas inyectando células de proteína X y células de control (células 293T transfectadas mediante un plásmido vacío) sobre un biochip modificado con anticuerpo anti-proteína X.
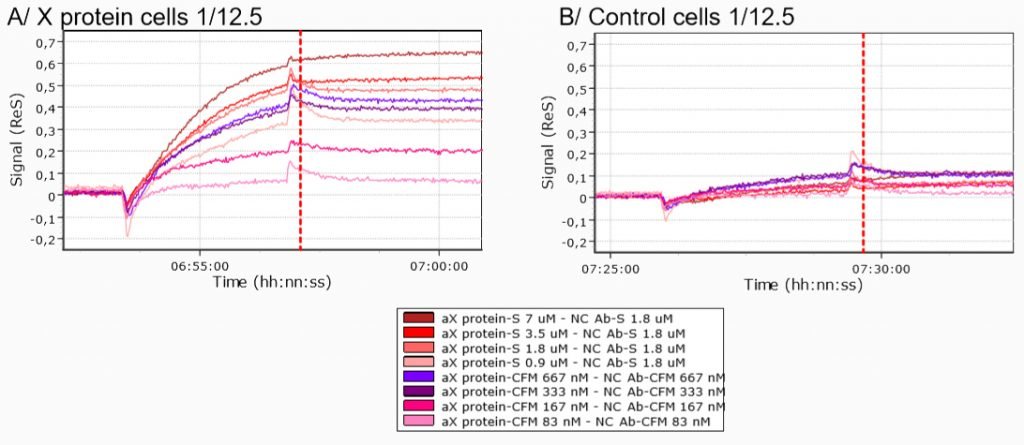
La comparación de las inyecciones de células de proteína X y células de control sobre el microchip modificado con anticuerpo anti-proteína X condujeron a diferencias claras en las curvas cinéticas, independientemente de las condiciones de inmovilización utilizadas.
Por lo tanto, los datos obtenidos demuestran la unión específica de las células de proteína X al anticuerpo anti-proteína X.
ANÁLISIS CINÉTICOS Y TERMODINÁMICOS DE LA INTERACCIÓN ANTICUERPO-CÉLULA
Las curvas cinéticas se obtuvieron inyectando células de proteína X sobre la superficie modificada con anticuerpo anti-proteína X a diferentes concentraciones. El método de deposición elegido es el que obtuvo los mejores resultados en el primer estudio de caso anterior.
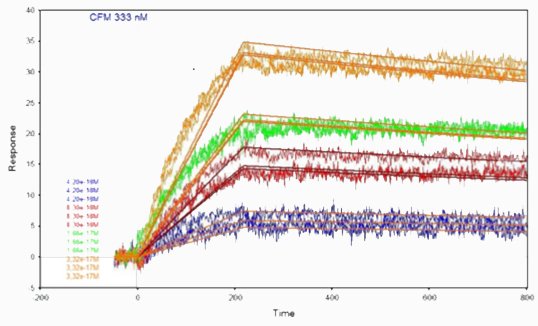
Los parámetros cinéticos se determinaron ajustando las curvas a diferentes concentraciones con un modelo de interacción 1:1.D El valor de la KD del anticuerpo se obtuvo calculando el cociente Kd/ka.
| Parámetros cinéticos y termodinámicos | |||
|---|---|---|---|
| ka(M-1.s-1) | kd (s-1) | KD (M) | |
| Anti-proteína X/células de proteína X | 1.00.1010 | 2.46.10-4 | 2.46.10-14 |
CONCLUSIÓN
Se demostró la unión específica de las células de proteína X al anticuerpo anti-proteína X mediante SPRi.
Las señales de SPRi permitieron la medición de una KD aparente baja, lo que se puede interpretar como una interacción anticuerpo-célula de alta afinidad. Esta afinidad de unión viene regida principalmente por una tasa de asociación alta (ka). La configuración de multiplexión del sistema SPRi permitió inmovilizar el anticuerpo anti-proteína X sobre un mismo biochip con los dos métodos de inmovilización diferentes y a cuatro concentraciones diferentes para cada método de inmovilización. Durante este experimento, se ensayaron 8 condiciones experimentales diferentes y se generaron 282 sensogramas diferentes en un único biochip.
Estudio de caso 2: estudio de la KD de un anticuerpo mediante análisis con Biacore
OBJETIVO DEL ESTUDIO
Un cliente nos solicitó la medición de la KD de una interacción anticuerpo/antígeno mediante Biacore. El objetivo del proyecto era clasificar la afinidad de 5 anticuerpos diferentes contra un mismo antígeno.
CONDICIONES EXPERIMENTALES
El antígeno se inmovilizó sobre la superficie del biochip revestido con dextrano mediante química de la maleimida clásica, lo que condujo a un enlace covalente tioéter estable. A continuación, se añadieron soluciones que contenían los anticuerpos en diversas concentraciones sobre el antígeno. La medición de la señal de SPR a diferentes concentraciones de anticuerpo permitió la determinación de los parámetros cinéticos (constante de asociación ka.constante de disociación kd) y los parámetros termodinámicos (KD).
MEDICIÓN DE LA AFINIDAD DE LOS ANTICUERPOS
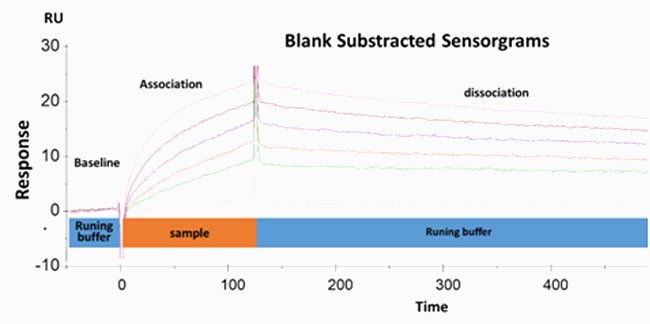
La afinidad de unión anticuerpo/antígeno se puede deducir del cociente KD/KA. lo que conduce a la posibilidad de deducir la clasificación jerárquica de su afinidad.
| Anticuerpo | ka (1/Ms) | kd (1/s) | KD (M) |
|---|---|---|---|
| A | 4.30×104 | 2.24×10-4 | 5.21×10-9 |
| B | 1.26×105 | 9.08×10-4 | 7.23×10-9 |
| C | 6.71×105 | 3.85×10-4 | 5.73×10-10 |
| D | 2.53×105 | 4.03×10-4 | 1.59×10-9 |
| E | 2.36×105 | 7.97×10-4 | 3.72×10-9 |
La clasificación de la afinidad de los anticuerpos se puede deducir directamente del valor de KD ya que cuanto menor sea el valor de KD mayor es la afinidad del anticuerpo.
Clasificación jerárquica de la KD de los anticuerpos: C < D < E < A < B
Clasificación jerárquica de la afinidad de los anticuerpos: C > D > E > A > B
CONCLUSION
El análisis mediante Biacore permitió llegar a la conclusión de que los 5 anticuerpos ensayados mostraban alta afinidad frente al antígeno y de que C era el mejor por varios motivos:
- KD inferior que es un indicativo de una interacción fuerte,
- parámetros cinéticos favorables (velocidad de asociación rápida y velocidad de disociación lenta).
